Fókuszban a klinikai onkológiai lehetőségek
A hepatocellularis carcinoma kezelése
A HCC-k jelentős hányada krónikus májbetegség talaján alakul ki, amelyet viralis hepatitis, alkoholabúzus vagy nem alkoholos steatohepatitis okoz, így a megelőzéshez elsősorban ezeket a májbetegségeket kell visszaszorítani. A sikeres kezelés kulcsa HCC esetében is a korai diagnózis, amit a használatban lévő stádiumbesorolási rendszerek is tükröznek.
A hepatocellularis carcinoma (HCC) a férfiak daganatos halálozásának második, a női daganatos halálozások hatodik leggyakoribb oka a világon, és incidenciája folyamatosan növekszik; 2008-ban 749 700 új esetről számoltak be. Az esetek több mint felét Ázsiában észlelik, az incidenciaráta Kína egyes részein, Délkelet-Ázsiában és Afrika szubszaharai régiójában a legmagasabb, valószínűleg a krónikus hepatitis B vírus-fertőzések és az aflatoxin hatása következtében.
A HCC annál eredményesebben kezelhető, minél koraibb stádiumban kerül diagnosztizálásra. A korai diagnózisra a nagy kockázatú betegek (májcirrhosisban szenvedők, hepatitis B vírus-hordozók) aktív szűréseadja a legnagyobb esélyt. Erre a szérum alfa-fetoprotein (AFP) szintjének monitorozása és máj-ultrahangvizsgálat javasolt 6–12 havonta. Ha az AFP-szint emelkedéséhez egy 1 cm-nél nagyobb májnodulus megjelenése társul, azt HCC-re gyanús elváltozásnak kell tekinteni.
A tumor vérellátását az a. hepatica ágai adják, és mivel a laesio hipervaszkularizált, a kontrasztanyagos CT- vagy MR-vizsgálatok során a korai artériás fázisban halmozást, a vénás fázisban pedig kimosódást mutat. Krónikus májbetegség esetén minden 1 cm-nél nagyobb, a fenti karakterisztikát mutató elváltozás HCC-nek tartandó.
Stádiumbeosztás
A HCC stádiumbeosztására a klinikai gyakorlat alapjain nyugvó Cancer of the Liver Italian Program (CLIP) és a Barcelona Clinic Liver Cancer (BCLC) rendszere vált a legelterjedtebbé. A CLIP beosztás a Child−Pugh-pontszámon (1. táblázat), a tumor morfológiáján (uninoduláris, multinoduláris vagy kiterjedt), az AFP-szinten és a portalis vénás thrombosis meglétén/hiányán alapul (2. táblázat).
1. táblázat. Child−Pugh-féle osztályozás a hepaticus funkciók karakterizálására
|
Child−Pugh-pontszám |
1 pont |
2 pont |
3 pont |
|
Összbilirubinszint, μmol/l (mg/dl) |
34−50 (2−3) |
>50 (>3) |
|
|
Szérumalbuminszint, g/dl |
>3,5 |
2,8−3,5 |
<2,8 |
|
PT INR |
<1,7 |
1,71−2,30 |
>2,30 |
|
Ascites |
nincs |
enyhe |
közepestől a súlyosig |
|
Hepaticus encephalopathia |
nincs |
grade I-II (vagy gyógyszeresen kezelt) |
grade III-IV (vagy refrakter) |
2. táblázat. A CLIP pontrendszer elemei
|
CLIP-pont |
0 |
1 |
2 |
|
Child−Pugh-osztály |
A |
B |
C |
|
A tumor morfológiája |
uninoduláris és kiterjedése ≤50% |
multinoduláris és kiterjedése ≤50% |
masszív és kiterjedése >50% |
|
AFP |
<400 |
≥400 |
|
|
Portalis véna trombózisa |
nem |
igen |
|
A BCLC beosztás része a Child−Pugh-pontszám, a beteg általános állapota és a tumor stádiuma (szoliter, multinoduláris, vaszkuláris invázó megléte vagy extrahepaticus terjedés). A korai stádiumú HCC-s betegek (BCLC stádium A1–A4), jól kompenzált (Child−Pugh A osztály) májrezerv-kapacitással rendelkeznek, kiváló az általános állapotuk és alacsony a tumortömegük. Az intermedier (köztes) stádiumú HCC-s betegek (BCLC stádium B) jó és közepes májrezervvel (Child–Pugh osztály A és B), kiváló általános állapottal és multinoduláris tumorral jellemezhetők. Az előrehaladott HCC-s betegek jellemzője a (BCLC stádium C) jó és közepes májrezerv (Child−Pugh osztály A és B), a vaszkuláris invázió vagy az extrahepaticus betegség, valamint a rosszabb általános állapot (Eastern Cooperative Oncology Group [ECOG] 1-2). A BCLC D stádium a terminális állapotot jelzi.
A BCLC beosztás óriási előnye az, hogy az öt stádiumba (0-A-B-C-D) való besorolás terápiás algoritmust is jelent, így megszabja a beteg onkológiai kezelését is (1. ábra).
1. ábra A BCLC szerinti klinikai stádiumbeosztás a kezelési irányelvekkel
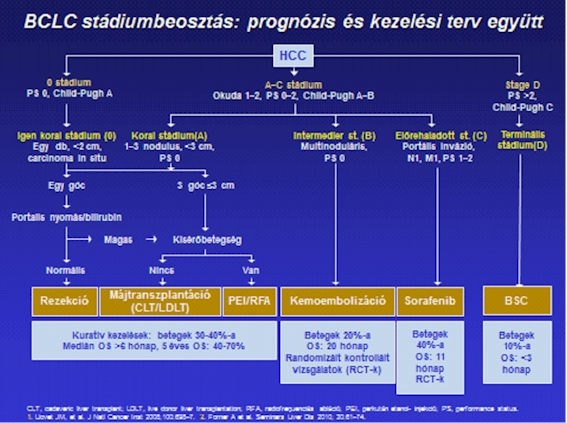
A BCLC 0-1 stádiumú betegek kezelése
Májtranszplantáció
A májtranszplantáció a HCC és a daganatot okozó betegség együttes kezelésében a legeredményesebb opció. A betegek transzplantációra való alkalmasságának megítélésére leginkább az úgynevezett milánói kritériumokat használják, így transzplantációra akkor kerülhet sor, ha a 3 cm-nél nem nagyobb gócokban lévő HCC nem detektálható több mint 3 fókuszban, vagy egy góc esetén annak mérete nem több mint 5 cm. A milánói kritériumok szerint kiválasztott májtranszplantált HCC-s betegek 5 éves túlélése 75%, ami megegyezik a nem tumor miatt transzplantált betegek hasonló adatával.
Sebészi kimetszés
A májreszekció ma is a HCC gyógyításának aranystandardja. A műtét előtt azonban mérlegelni kell, hogy kielégíti-e az életfunkciókat a sokszor sérülékeny és beteg maradék májparenchyma, így az operáció inkább csak egyszeres tumor és megőrzött májfunkciók mellett javasolt. A reszekció után a rekurrenciaráta két évnél 50%, öt évnél pedig 75%.
Sztereotaxiás sugárkezelés
A sztereotaxiás sugárkezelés (stereotactic body radiation therapy: SBRT) során a céltérfogatot számítógépes modellezéssel határozzák meg. A kezelés igen effektív lehet; egy vizsgálat szerint a maximum 6 cm-es szoliter laesióval, vagy maximum 3 darab, de 3 cm-nél nem nagyobb HCC-vel kezelt betegkohorszon Child−Pugh A osztályú betegeknél 3, Child−Pugh B osztályú betegeknél pedig 5 frakcióban adott 16 Gy sugárdózissal 90%-os 2 éves tumorkontrollrátát értek el.
Abláció
Az abláció kuratív opciót jelenthet azok számára, akiknél sebészi beavatkozás már nem jön szóba. Az abláció a 2-3 cm-nél kisebb laesiók esetén a legeredményesebb, 3 cm-es tumornagyság felett a sikeres ablációk gyakorisága szignifikánsan csökken. Nagyobb vagy többgócú tumorok esetében az abláció kombinálható embolizációval, 7 cm-nél nem nagyobb szoliter góc esetén az 5 éves túlélés a sebészi reszekció túlélésével összevethető. Az abláció lehet termális (RFA: rádiófrekvenciás abláció, mikrohullámú, lézer indukálta interstitialis termoterápia, magas intenzitású fókuszált ultrahang- vagy krioabláció) vagy kémiai (etanollal − PEI: perkután etanolinjekció; vagy ecetsavval).
HCC esetében a lágy tumort többnyire fibrotikus és kemény májszövet veszi körül, így létrejöhet az effektivitást nagymértékben fokozó, ún. „kemencehatás”, amikor a tumor hőkezelését „leszigeteli” a cirrhoticus májszövet. A kémiai abláció esetén is megfigyelhető hasonló effektus. Az ablációs technika megválasztása függ a target laesio lokalizációjától és méretétől. 2 cm alatti tumorméret esetén az RFA és a PEI túlélési eredményei hasonlók, de 2 cm-nél nagyobb tumorok esetén az RFA előnyösebb. Az RFA azonban érzékeny a „heat sink” (hőelszívás) jelenségére, amikor a tumorhoz közeli nagyobb érben folyó vér hűtheti az ablálni kívánt laesiót, jelentősen rontva az eredményességet. Nagyobb vagy multiplex elváltozások esetén a sikeres ablációk rátája jelentősen csökken.
Abláció után az ideális válasz képe egy nekrotikus, nem halmozó lézió, mely legalább 2 cm-rel nagyobb, mint a kezelt tumor volt. Emiatt az eredeti tumorméretek rögzítése az ablációs kezelés előtt alapvető fontosságú a tumorválasz értékelése érdekében.
A BCLC B stádiumú betegek kezelése: embolizáció
A májparenchyma tápanyagellátásáért elsősorban a vena portae rendszere felelős, de a HCC-s laesiók ellátása az arteria hepatica ágain keresztül történik, lehetővé téve, hogy az intraarteriális katéteres kezeléseket célzottan a tumorra lehessen adni.
Jelenleg még nem érhető el olyan erős evidenciákkal rendelkező adat, amely meghatározná a lehetséges kezelések egymáshoz viszonyított túlélési előnyét, azonban a legtöbb centrumban a standard embolizációs kezelés a TACE (transzarteriális katéteres kemoembolizáció).
Egy nagy prospektív, randomizált vizsgálat, mely a TAE-t (transzarteriális katéteres embolizáció), a TACE-t és a legjobb ellátást (best supportive care: BSC) hasonlította össze, bebizonyította, hogy a TACE jobb, mint a BSC, de nem volt különbség a TAE és a TACE kar között. Egy friss Cochrane-metaanalízis szerintnincs olyan megfelelő evidenciaszinttel rendelkező klinikai vizsgálat vagy metaanalízis, amelynek alapján a TAE vagy a TACE alkalmazását egyáltalán meg lehetne erősíteni, vagy el lehetne vetni. Egy másik tanulmány szerint 2 metaanalízis eredménye sem mutatott túlélési különbséget a TACE javára a TAE-vel szemben. Egy hét randomizált vizsgálatot felhasználó metaanalízis eredményei alapján a TAE/TACE túlélési előnyt adott a kontrollhoz képest. Az adatok analízise azt is mutatta, hogy a cisplatinnal vagy a doxorubicinnel végzett TACE szignifikáns benefíciummal rendelkezik.
A tumorválasz értékelésére katéteres beavatkozás után a módosított RECIST (modified Response Evaluation Criteria In Solid Tumors: mRECIST) kritériumok szerint a TACE-ra adott válasz definíciójaként a korai artériás fázisban történő halmozás megváltozása vagy elmaradása vizsgálandó (3. táblázat).
3. táblázat. Az mRECIST kritériumok
|
A target laesiók válaszának elemzése: konvencionális és a módosított RECIST kritériumok szerint HCC-ben, az AASLD-JNCI irányelvek szerint |
|
|
RECIST |
mRECIST HCC-hez |
|
CR: minden target laesio eltűnése |
CR: minden intratumorális kontrasztanyag-halmozás eltűnése a target laesiókban |
|
PR: legalább 30% csökkenés a target laesiók átmérőinek összegében, a kezelés előtt meghatározott kiindulási értékhez viszonyítva |
PR: legalább 30% csökkenés a viábilis target laesiók (kontrasztanyag-halmozás az artériás fázisban) átmérőinek összegében, a kezelés előtt meghatározott kiindulási értékhez viszonyítva |
|
SD: minden eset, amely nem CR, nem PR, és nem progresszív betegség |
SD: minden eset, amely nem CR, nem PR, és nem progresszív betegség |
|
PD: legalább 20%-os növekedés a target laesiók átmérőinek összegében, a kezelés kezdete óta mért legkisebb összeghez viszonyítva |
PD: legalább 20%-os növekedés a viábilis (kontrasztanyagot halmozó) target laesiók átmérőinek összegében, a kezelés kezdete óta mért legkisebb összeghez viszonyítva |
|
AASLD: American Association for the Study of Liver Diseases; JNCI: Journal of the National Cancer Institute; HCC: hepatocellularis carcinoma; mRECIST: modified Response Evaluation Criteria in Solid Tumors; CR: komplett válasz; PR: parciális válasz; SD: stabil betegség; PD: progresszív betegség |
|
Egy tervezett TACE várható eredményességének meghatározása céljából alkalmazzák az ART pontrendszert (4. táblázat), amely mind az első, mind az összes többi TACE-kezelés előtt alkalmazható. Abban az esetben, ha az ART-pontszám kedvező (0–1,5), a tervezett kezelésnek a várható előny miatt van jogosultsága, de a rossz prognózist jelentő ART-pontszám esetén (≥2,5) a beteg számára terápiaváltás javasolt.
4. táblázat. Az ART pontrendszer
|
ART pontrendszer |
|
|
|
Pontok |
|
Radiológiai tumorválasz |
|
|
nincs |
1 |
|
van |
0 |
|
SGOT-növekedés >25% |
|
|
van |
4 |
|
nincs |
0 |
|
Child—Pugh-pontszám növekedése |
|
|
1 pont |
1,5 |
|
≥2 pont |
3 |
|
nincs |
0 |
|
|
|
A válasz értékelése és a várható benefícium meghatározása minden egyes TACE-ciklus után/előtt történjék meg, hogy el lehessen kerülni az ún. „túl-TACE-zést”, és a beteg a lehető leghamarabb a stádiumának megfelelő hatásos kezelésben részesülhessen.
Transzarteriális katéteres embolizáció (TAE)
Ennél a katéteres kezelési opciónál kis partikulumokat (40 µm-120 µm) injektálnak a tumort ellátó artériás ágba, melyek a kis terminális érágakban elakadva a daganat ischaemiás nekrózisát okozzák. A válaszrátára és a túlélésre vonatkozó ötéves adatok az egyéb katéteres technikák hasonló adataival összevethetők. Az eredményesség azonnal mérhető, a nekrózis radiológiai jelei órákon belül detektálhatók. Olyan, nagy tumortömeggel kezelendő betegek részére ajánlott, akik a további tumornövekedés miatt kezelésre alkalmatlanná válnának.
Transzarteriális katéteres kemoembolizáció (TACE)
A TACE-t általában doxorubicinnel és cisplatinnal végzik. A beavatkozás során a hidrofil kemoterápiás szert (lipiodollal vagy lipiodol nélkül) injektálnak az arteria hepaticán keresztül a májba, majd a kimosódás megelőzése és a kemoterápiás szer hosszabb behatásának biztosítása céljából a tumort tápláló eret elzárják, így a kezelés ischaemiás effektusát egy erős citotoxikus hatással kombinálják.
Csak a jó általános állapotú, megfelelő májfunkciójú betegek alkalmasak a beavatkozásra, vaszkuláris inváziót vagy extrahepaticus terjedést mutató laesiók esetén nem várható előny. Egy klinikai vizsgálatban, ahol a betegeket kompenzált cirrhosissal (70% Child−Pugh A), ECOG 0-s általános állapottal, vaszkuláris invázió vagy extrahepaticus terjedés nélküli, tüneteket nem mutató nagy vagy multinoduláris HCC-vel kezelték, a konvencionális TACE-t követő 2 éves túlélés 63% volt, míg a kezelést nem kapottak esetében ez a mutató csak 27%-nak adódott (p=0,009). Egy másik vizsgálatban portalis invázió, ill. daganat okozta tünetek is jelen voltak, a 2 éves túlélés csak 31% volt. Itt a portalis inváziót mutató alcsoport esetében túlélési előny nem mutatkozott.
A TACE abszolút kontraindikációja a dekompenzált cirrhosis (Child–Pugh B ≥8), az extenzív, mindkét lebenyre kiterjedő tumor, a súlyosan károsodott portalis áramlás, veseelégtelenség és a technikai kivitelezhetetlenség. A relatív kontraindikációk közé tartozik a tumor 10 cm-nél nagyobb mérete, valamint a rossz szervi funkciókat eredményező kísérőbetegségek (aktív kardiovaszkuláris vagy tüdőbetegség), a magas vérzési rizikót jelentő oesophagusvarixok vagy epeúti okklúzió fennállása.
A TACE adható fix időközönként, 6–12 hetente vagy akár 6 havonta is. A másik megközelítés az „igénynek megfelelően” (on-demand) adott TACE, ami a radiológiai tumorválasz értékelésén alapul. Sajnos sem az alkalmazott kemoterápiás szereket, sem pedig a kezelési sémákat illetően nem rendelkezünk erős evidenciákkal. Az egyik legelterjedtebb szemléletmód az AASLD kezelési algoritmust használja (2. ábra).
2. ábra. A TACE kezelési algoritmusa
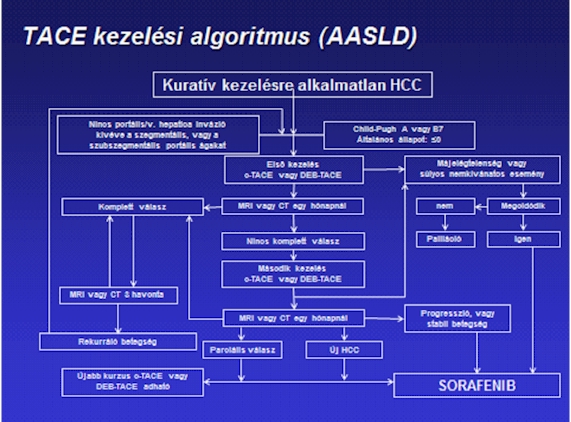
Transzarteriális katéteres kemoembolizáció gyógyszerkibocsátó gyöngyökkel (DEB-TACE)
A gyógyszerkibocsátó gyöngyök (drug eluting beads: DEB) alkalmazása mindenképpen előrelépés a TACE-hoz képest, így a nyugati centrumokban a konvencionális TACE nagyrészt kiszorult. A DEB-ek deformálható mikrogömbök, amelyeket doxorubicinnel töltöttek fel (150 mg is lehet kezelésenként). Ez biztosítja a sokáig tartó és maximalizált intratumorális gyógyszer-felszabadulást, és pontosan kalibrálható az elzárt erek átmérője. A doxorubicin szérum-csúcskoncentrációja egy nagyságrenddel alatta van a konvencionális TACE során észleltnek. A PRECISION V vizsgálatban a DEB TACE esetén a májtoxicitás és a gyógyszerrel összefüggő nemkívánatos események markáns redukcióját észlelték. A DEB TACE esetén az objektív válaszráta (ORR: objective response rate) 70 és 80%, az egyéves és a hároméves túlélési ráta pedig 89,9 és 66,3% volt. A DEB-TACE a TAE-vel szemben jobb 12 hónapos tumorprogressziós rátát (46% vs. 78%, P=0,002) és progresszióig eltelt időt (TTP) mutatott (36,2 vs. 42,4 hét, P=0,008).
Transzarteriális katéteres radioembolizáció (TARE)
Az ittrium-90 egy üveg vagy műgyanta mikrogömböcskékbe tölthető béta-emitter, amely aztán a májartériába fecskendezhető mikrokatéterrel. A radioembolizáció előnye, hogy rosszabb májfukciók (Child−Pugh B osztály) esetén is alkalmazható, a kezelés válaszrátája összevethető a többi katéteres eljárásban észleltekkel. A gastrointestinalis traktus és a tüdő non-target embolizációja azonban különösen súlyos szövődmény lehet.
A BCLC C stádiumú betegek kezelése: sorafenib
Az irreszekábilis HCC kezelési opciói limitáltak. A szisztémás kemoterápia, a hormonkezelés vagy az immunterápia (interferon) eredményei meglehetősen szerények, a válaszráta kevesebb mint 30%, és a túlélésben nem is mutatkozik előny.
A HCC azonban hipervaszkularizált tumor, és emiatt az angiogenezis szerepe a tumor kifejlődésében, növekedésében és progressziójában is széles körben tanulmányozott. A HCC-ban zajló angiogenezis serkentésében részt vesz a VEGF (vascular endothelial growth factor), a PDGF (platelet-derived growth factors) (PDGFs), az FGF (fibroblast growth factor), a TGF-a és b (transforming growth factor) és ezek receptorai. Ezek a növekedési faktorok olyan angiogenetikus jelátviteli utakat aktiválnak, mint a RAF/MEK/ERK és a PI3K/AKT/mTOR.
A sorafenib egy multi-tirozinkináz-inhibitor (TKI), amely az angiogenetikus jelátvitel számos kulcsfontosságú modulátorát blokkolja, mint pl. a sejtfelszíni VEGF- és PDGFR-receptorokat, de néhány intracelluláris szerin/treonin kinázt (RAF-1, B-RAF) is képes gátolni.
A sorafenib két, III. fázisú, randomizált, placebokontrollált klinikai vizsgálat eredményeivel megerősítve túlélési előnyt biztosít az előrehaladott HCC kezelésében.
A Sorafenib Hepatocellular Carcinoma Assessment Randomized Protocol (SHARP) vizsgálatban a 2×400 mg sorafenibet placebóval hasonlították össze Amerikában és Európában. A sorafenibkaron 299, a placebokaron pedig 303 előrehaladott HCC-s, Child−Pugh A májfunkciójú beteget vontak be. A betegek 30%-a HCV-, 20%-a HBV-fertőzött volt, 25%-uknál pedig alkoholos májbetegség volt a háttérben. A tervezett interim analízis időpontjában a vizsgálat elsődleges végpontja teljesült, a sorafenib szignifikánsan javította a teljes túlélést (OS) (10,7 vs. 7,9 hónap, HR: 0,69 (P<0,001). Az összetett betegségkontroll-ráta (CR+PR+SD) a sorafenibkaron szignifikánsan magasabb volt (43 vs. 32%), azonban a RECIST kritériumok szerint értékelt tumorválaszok száma összesen 9 volt. Az adat azt bizonyítja, hogy a sorafenib a HCC kezelésében nem indukál tumorméret-csökkenést, a túlélés a betegség stabilizációja révén hosszabbodik meg.
A másik, ázsiai vizsgálatban Child−Pugh A májfunkciós állapotú HCC-s betegeket randomizáltak sorafenib- (2×400 mg naponta, n=150) vagy placebokarra (n=76). A sorafenibkaron a medián OS 6,5 hónap, míg a placebokaron 4,2 hónap volt (HR: 0,68; p=0,014).
A sorafenib mindkét vizsgálatban jól tolerálható volt, a leggyakoribb nemkívánatos események közé a hasmenés, a fáradtság és a kéz-láb bőrreakció (HFSR: hand-foot skin reaction) tartoztak.
A két vizsgálat OS eredményei között azonban elgondolkodtató különbség van. Ennek okai az előzetes lokoregionális kezelések és a HCC etiológiája közti különbségek lehetnek. Az ázsiai betegek közt több volt a HBV okozta HCC (73 vs. 18%), míg a SHARP vizsgálatban több volt a HCV okozta HCC (28 vs. 8%). A SHARP vizsgálatban a betegek 97%-a Child−Pugh A funkciókkal rendelkező cirrhoticus beteg volt, így innen nincsenek megfelelő adatok a Child−Pugh B stádiumú betegek sorafenibkezeléséről. Egy fázis II. vizsgálat a Child−Pugh A és B osztályú betegek sorafenibkezelése során 41 vs. 14 hét medián OS-t igazolt a jobb májfunkciójú csoport javára.
Egy 296 beteget (88% Child−Pugh A, 75% Barcelona Clinic Liver Cancer [BCLC]-C és 25% BCLC-B) beválasztó olasz multicentrikus obszervációs vizsgálatban a medián OS 10,5 hónapnak bizonyult, de az intermedier stádiumban (BCLC-B) lévő betegek esetén ez majdnem kétszeresnek, 20,6 hónapnak adódott. A megfigyelés során a betegek 54%-ánál kellett dózisredukciót alkalmazni, a betegek 40%-a mellékhatás, míg 16%-a a májfunkciók romlása miatt hagyta abba a kezelést.
Egy másik olasz retrospektív obszervációs vizsgálatban 14 Child−Pugh A, 70 Child−Pugh B és 9 Child−Pugh C májfunkcióstátussal rendelkező sorafenibbel kezelt HCC-s beteg medián OS-e 12 hónap volt, a TTP pedig 3 hónapnak bizonyult. A Child−Pugh-pontszám statisztikailag szignifikánsan befolyásolta a TTP-t, ez 6,6 hónap volt a Child−Pugh A, 2,8 hónap a Child−Pugh B és 2,0 hónap a Child−Pugh C betegek esetében (p=0,012).
A legnagyobb obszervációs vizsgálat a GIDEON (Global Investigation of therapeutic DEcisions in hepatocellular carcinoma [HCC] and Of its treatment with sorafeNib), amelyben nem reszekábilis HCC-s betegek sorafenibkezelését követték a valós klinikai gyakorlatban. Az a beteg, akit kezelőorvosa sorafenibkezelésre alkalmasnak tartott, bekerülhetett a vizsgálatba. A második interim analízis idején 1571 olyan kezelt beteg gyógyszer-biztonságossági adatait elemezték, akiket legalább 4 hónapig követtek. A betegek 61%-a Child−Pugh A, 23%-a pedig Child−Pugh B státusú volt. 74%-uk kapott teljes, 800 mg/die kezdődózist a sorafenibből. A mellékhatásprofil az eddig ismert adatoknak megfelelően alakult. A vizsgálat végső analízisét 3202 beteg adatai alapján közölték. A Child−Pugh A betegek esetében hosszabb volt a kezelésen töltött idő (17,6 vs. 9,9 hét), a medián OS (13,6 vs. 5,2 hónap).
A fentiek alapján a sorafenib az előrehaladott HCC (BCLC C stádiumú) kezelésének standardja. Minden betegcsoportban túlélési előnyt biztosít, de a kezelésből a legtöbbet a májfunkciók szempontjából a Child−Pugh A osztályba tartozók profitálják.
Mivel a sorafenib hatásmechanizmusát tekintve antiangiogenetikus gyógyszer, a sorafenib indukálta HCC-s tumorválasz felmérésében hasznosabb lehet a vaszkularizáltságot tükröző kritériumok használata (mRECIST, Choi, EASL). Az elérhető, bár sajnos, kis betegszámú vizsgálatok szerint ezek az értékelési rendszerek a RECIST 1.1-gyel megegyező módon detektálják a progressziót, azonban lényegesen magasabb az új rendszerek szerinti értékelésben a tumorválaszt adók száma. Ezekben az esetekben a tumorválasz prognosztikai marker is, amely jelentősen jobb várható túlélési mutatókat jelez a stabil betegséget mutató betegekhez képest.




