Posztreszuszcitációs ellátás csecsemő- és gyermekkorban
A csecsemő- és gyermekkori hirtelen keringésmegállás patofiziológiája jelentősen eltér a felnőttkoriétól, és ritkábban is fordul elő.1 Sajnos a sikeres gyermekkori újraélesztések aránya alacsony, az idegrendszeri kimenetel pedig sokszor kedvezőtlen. Az eredmények javításához a keringésmegállás megelőzése, hatékony alap- és emelt szintű újraélesztés, valamint korai agresszív intenzív terápia, neuroprotektív posztreszuszcitációs ellátás szükséges. A keringésmegállást és sikeres újraélesztést átélt gyermek komplex ellátását egész csapat végzi: a prehospitális és kórházi sürgősségi ellátókon, a gyermekintenzív osztály és a társszakmák személyzetén túl hosszú távon a házi gyermekorvos kollégák, rehabilitációs szakemberek, gyógypedagógusok szakértelme is elengedhetetlen.
A csecsemő- és gyermekkori hirtelen keringésmegállás és újraélesztés a felnőttkori esetekkel összehasonlítva sokkal ritkább, ugyanakkor mind a keringés visszatérése, mind az idegrendszeri kimenetel tekintetében rosszabb kimenetelű. Ennek hátterében a keringésmegállást kiváltó okok állnak:
– Felnőtteknél gyakori az elsődleges keringésmegállás (hirtelen szívhalál, szívizominfarktus, illetve malignus ritmuszavar következtében), így legtöbbször a szervek egyébként egyensúlyi, normoxiás helyzetben szenvedik el a keringésmegállást. Gyakori kezdeti ritmuszavar a kamrafibrilláció és a pulzus nélküli kamrai tachycardia – ezek rendszerint jól reagálnak korai defibrillációra.
– Gyermekeknél a másodlagos keringésmegállás jellemző, amely légzési vagy keringési betegség végállapotaként, a kompenzációs mechanizmusok kimerülését követően, oxigénhiányos szövetek mellett következik be (hypoxia – acidosis – bradycardia). Gyakori iniciális EKG-kép az asystolia és a pulzus nélküli elektromos aktivitás. Gyermekeknél a keringés visszatérését az újraélesztési protokoll alapján végzett adekvát lélegeztetéstől és mellkaskompressziótól, a gyógyszeres terápiától (adrenalin) és a reverzibilis okok kezelésétől várjuk.
Sikeres újraélesztés esetén a keringés visszatérése után (return of spontaneous circulation, ROSC) a szövetek által átélt oxigénhiány és a reperfúziós károsodás mentén komplex patofiziológiai folyamatok indulnak el, amelyeket keringésmegállást követő tünetegyüttesnek (postcardiac arrest syndrome, PCAS) nevezünk.2 A PCAS fő összetevői az alábbiak:
– Az agy károsodása (encephalopathia/eszméletlenség, agy-oedema, görcs/myoclonus)
– A szívizom működészavara (alacsony perctérfogat, értágulat, hipotenzió, tüdő-oedema, ritmuszavar, ismételt keringésmegállás)
– Szisztémás ischaemia-reperfúzió (gyulladásos aktiváció, véralvadási zavar, anyagcsere és endokrin reguláció zavara)
– Keringésmegállást kiváltó ok (pl. szeptikus sokk)
A PCAS kialakulása a keringés visszatérését követően azonnal elindul, tehát a minőségi túlélés, a súlyos idegrendszeri károsodás megelőzése, csökkentése érdekében korai, neuroprotektív posztreszuszcitációs ellátásra van szükség. A definitív posztreszuszcitációs ellátás gyermekintenzív centrumokban történik, azonban megkezdése az újraélesztést végző első ellátó feladata lehet – ehhez rendszeresen megújuló nemzetközi protokollok és szimulációs tanfolyamok állnak rendelkezésre.
A posztreszuszcitációs időszak legfontosabb teendői
A sürgősségi-intenzív betegellátásban minden súlyos állapotú beteg esetén javasolt az ABCDE ellátási séma alkalmazása, ez alapján csoportosíthatók a keringés visszatérése utáni teendők is (1. táblázat).

Oxigenizáció
A bevezetővel összhangban a gyermekkori keringésmegállás leggyakrabban oxigénhiányos eredetű, így kezelésében elsődleges a mielőbbi 100% O2-vel történő hatékony lélegeztetés. Szerveink közül az agy hypoxia-tűrőképessége különösen alacsony. A sikeres újraélesztést követően a keringésmegállás („no-flow”) és az újraélesztés („low-flow”) állapotához képest a szervperfúzió és az oxigénellátottság rendeződik, így számolni kell a reaktív oxigéngyökök okozta károsodással és a hyperoxia egyéb kedvezőtlen hatásaival. Az oxigenizáció monitorizálása a sürgősségi ellátásban pulzoximetriával (SpO2) történik, ami kórházon belül kiegészülhet egyéb (vérgáz, agyi oxigenizáció stb.) monitorizálási lehetőségekkel. A súlyos állapotú gyermekekre érvényes legújabb európai ajánlással összhangban, amennyiben az oxigénszaturáció megbízhatóan mérhető, és a beteg keringése stabilizálódik, a 100% O2-vel történő lélegeztetést felváltja a célzott oxigénterápia, 94% és 98% közötti célszaturáció tartásával. Egyes ritka esetekben a beteg megszokott szaturációja ennél alacsonyabb – pl. egykamrás keringés esetén a beteg normális oxigénszaturációját célozzuk meg.1
Ventilláció
Az agyi keringés egyik legfontosabb szabályozója a vér artériás szén-dioxid tenziója, melynek normál értéke 35–45 Hgmm. Krónikus tüdőbetegség esetén a normál érték ennél magasabb lehet, melyet a szervezet metabolikusan kompenzál. A szén-dioxid tenzió a percventilláció függvénye, melynek csökkenésekor hypercapnia, növekedése esetén pedig hypocapnia lép fel. Ahogy bármilyen súlyos agysérülés esetén, újraélesztést követően is kiemelten fontos a normális agyi perfúzió biztosítása. A szén-dioxid tenzió változásai (és az ennek megfelelő respiratorikus pH-eltérések) az agyi értónust szabályozzák, így súlyos hypocapnia esetén vazokonstrikció és ischaemia, súlyos hypercapnia esetén pedig vazodilatáció és hiperperfúzió alakulhat ki. A posztreszuszcitációs ajánlások korai légútbiztosítást, kontrollált lélegeztetést és szigorú normocapniát javasolnak, melynek monitorizálása folyamatos kapnográfia (EtCO2) alkalmazásával, illetve vérgázanalízissel (PCO2) lehetséges. A koponyaűri nyomásfokozódáskor korábban alkalmazott szándékos hiperventilláció az agyi ischaemia elkerülése érdekében ma már csak ritka és szélsőséges esetben, fenyegető beékelődés esetén jön szóba.
Keringés
Az újraélesztést követő órákban gyakran észlelhető keringési instabilitás. Felnőtteknél az agyi vérátáramlás (cerebral blood flow, CBF) és az artériás középnyomás (MAP) közötti összefüggés jól leírható (1. ábra).
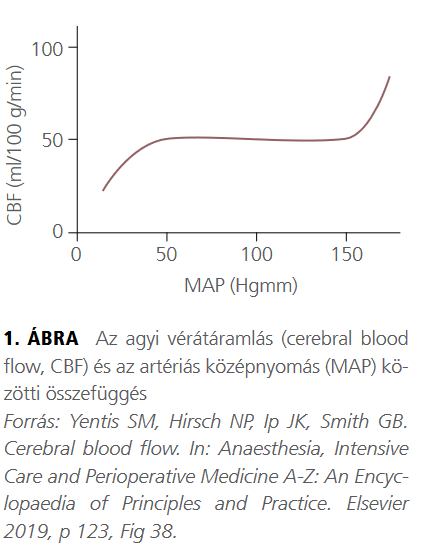
A görbén látható agyi autoreguláció, tehát a CBF perfúziós nyomástól független tartománya gyermekkorban nehezebben definiálható. Továbbá, a keringésmegállás által okozott inzultus kapcsán felborulhat az autoreguláció, így az agyi vérátáramlás nyomáspasszívvá válik. Az agyi keringés szempontjából az artériás középnyomáson kívül fontos tényező az intracranialis nyomás (ICP), valamint a szabad vénás elfolyás biztosítása is. Képalkotó vizsgálaton vagy klinikai jelek alapján felmerülő agy-oedema esetén a többi élettani paraméter normalizálásán túl gyógyszeres dehidráció (mannit vagy 3%-os NaCl-oldat), illetve szükség esetén idegsebészeti beavatkozás, ICP-mérés jön szóba kamra-drain behelyezésével.
Az újraélesztés hosszú távú kimenetelét és a terápiás hipotermia hatásait vizsgáló gyermekkori tanulmányok egyik egybehangzó megállapítása a sikeres újraélesztést követő hipotenzió kedvezőtlen hatása a túlélésre és az idegrendszeri kimenetelre. A keringésmegállás utáni átmeneti myocardium-depresszió, a szisztémás ischaemia-reperfúzió talaján kialakuló vazodilatáció, vagy a keringésmegállást kiváltó alapbetegség (pl. sepsis) hipotenziót vagy hemodinamikai instabilitást okozhat. Lényeges különbség a keringésmegállás után észlelt szívizom-károsodás tekintetében, hogy míg felnőtteknél a pumpafunkció javulását rendszerint a koszorúér-keringés helyreállításától várjuk, addig gyermekkorban rendszerint a keringésmegállás okozta szívizom-károsodás spontán javul, az inotrop kezelés legtöbbször rövidesen csökkenthető, leállítható.
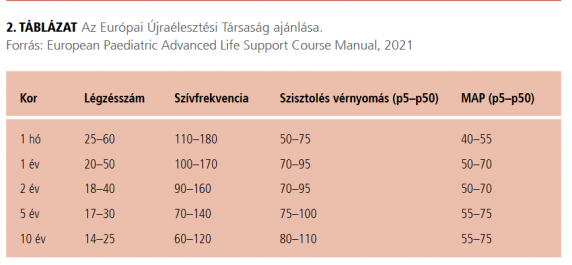
A súlyos állapotú gyermekek standard monitorizálásának része a szoros vérnyomáskontroll (folyamatos invazív vagy intermittáló noninvazív vérnyomásmérés). Az Európai Újraélesztési Társaság (European Resuscitation Council, ERC) ajánlása alapján az életkori normál értékek 5-ös percentilis alatti tartomány kerülendő, lehetőleg az 50-es percentilis feletti értéket javasolt tartani (2. táblázat).
Hipotenzió, illetve a keringési instabilitás egyéb jeleinek észlelésekor korai intravénás vagy intraossealis folyadékbólus (alkalmanként 10 ml/kg cukormentes krisztalloid oldat), illetve helyi protokoll alapján vazoaktív kezelés megkezdése javasolt. A gyógyszeres keringéstámogatás részletes leírása a gyermekintenzív terápia tárgykörébe tartozik. A következő táblázatban a különböző vazoaktív szerek jellemző kezdő dózisát tüntettük fel (3. táblázat).

Idegrendszer
A sikeres újraélesztést követően észlelt tünetegyüttes (PCAS) egyik legfontosabb eleme az idegrendszer sérülése. A többi agysérüléshez hasonlóan az átélt primer inzultus (keringésmegállás, agyi hypoxia) utólagos befolyásolására nincs mód, azonban a szekunder károsodások megelőzése nagyon fontos feladatunk.
Sikeres újraélesztést követően a kritikus állapotú, lélegeztetett, szedált betegnél az idegrendszeri tünetek felmérése korlátozott értékű. Ugyanakkor bármilyen egyértelmű kóros neurológiai tünetet (góctünet, meningealis izgalmi jel), valamint a korhoz adaptált Glasgow Coma skálát vizsgálnunk és dokumentálnunk kell. A GCS paraméterei közül legfontosabb prognosztikus tényező a motoros skála (4. táblázat).
4. táblázat A Glasgow Coma skála paraméterei
Forrás: European Paediatric Advanced Life Support Course Manual, 2021
5 év felett 5 év alatt
Szemnyitás
E4 Spontán
E3 Felszólításra
E2 Fájdalomra
E1 Nincs reakció
C Szemek duzzanat vagy kötés miatt csukva
Verbális válasz
V5 Orientált (térben-időben) Éber, gügyög, megszokott szavakra vagy mondatokra képes
V4 Zavart Irritabilis sírás, megszokottnál gyengébb verbális képesség
V3 Nem megfelelő szavak Fájdalomra sír
V2 Érthetetlen hangok Fájdalomra nyög
V1 Fájdalomra sincs reakció
T Intubált beteg
Motoros válasz
M6 Utasítást végrehajt Spontán célirányosan mozog
M5 Supraorbitalis fájdalmas ingert lokalizál (9 hónap felett), érintésre elhárít
M4 Körömre gyakorolt fájdalmas ingert elhárít
M3 Supraorbitalis fájdalomra flexió (decorticalt)
M2 Supraorbitalis fájdalomra extenzió (decerebralt)
M1 Fájdalomra sincs reakció
A GCS összpontszáma 3 és 15 között változhat, a leírásnál pedig fel kell tüntetni az egyes kategóriákra külön-külön adott pontokat (pl. GCS E4-V5-M6).
A GCS-nél kevésbé kifinomult és részletes, de egyszerűbben megjegyezhető az AVPU skála (5. táblázat).
5. táblázat: Az AVPU skála
A Alert Éber
V Verbal Csak megszólításra reagál
P Pain Csak fájdalomingerre reagál
U Unresponsive Fájdalomingerre sincs reakció
Fontos dokumentálni a pupillák tágasságát és reakcióképességét is, azonban a keringő nagy mennyiségű katecholamin miatt közvetlenül az újraélesztés után ez még nem informatív. A pupillák reakcióképességétől nem várható hosszú távú prognosztikus információ.
Lényeges az ágymelletti vércukorszint-meghatározás és annak követése. Egyéb okból kritikus állapotú gyermekekhez hasonlóan 6–10 mmol/l közötti célérték elfogadható, hypoglykaemia esetén azonban azonnali intravénás glükózpótlás szükséges. A hyperglykaemia ebben az időszakban a keringő katecholaminok és glükokortikoidok miatt gyakori, spontán rendeződik. Inzulin adására ilyenkor általában nincs szükség, a túlságosan szoros vércukorkontroll a hypoglykaemiás epizódok esélyét növeli.
Az újraélesztett gyermek esetében a görcsroham a korai idegrenszeri károsodás oka és következménye is lehet, mindenképpen korán és agresszívan kezelendő. Konvulziót kiváltó egyéb fiziológiai okok (hypoxia, hypoglykaemia, hyponatraemia) kezelése mellett protokollnak megfelelő gyógyszeres görcsgátlás szükséges. Gyakoriak a klinikailag nehezen megítélhető és gyógyszeres kezelésre rezisztens myoclonusok, valamint a motoros konvulzióval nem járó, csak az EEG-n látható nonkonvulzív görcsök is. Ez utóbbiak felismerését és követését folyamatos intenzív osztályos EEG monitorizálás teszi lehetővé.
Az idegrendszer felmérésénél merül fel a prognózis kérdése. Ritka kivételektől eltekintve az idegrendszeri kórjóslat nehéz, hosszabb megfigyelést igényel, emiatt a korai időszakban nem javasolt a hozzátartozóknak ilyen irányú tájékoztatást adni. Kivétel lehet például újraélesztést követően röviddel magához térő gyermek, vagy a másik végletként az agyhalál tüneteit mutató beteg. A szakirodalom általában körülbelül 72 órával a sikeres újraélesztés után javasolja a prognózis első megítélését. Agyi képalkotó vizsgálatok (CT, MR) ezen időpont előtt általában csak olyan esetben javasoltak, ha valamilyen intracranialis elváltozás lehetősége merül fel a keringésmegállást előidéző ok hátterében. Az idegrendszer állapotát és működését felmérő vizsgálómódszerek (képalkotók, biomarkerek, EEG, intracranialis nyomásmérés – ICP, közeli infravörös spektroszkópia – NIRS) önmagukban nem alkalmasak az idegrendszeri kimenetel becslésére, azonban több módszer és a klinikum együttesen már releváns információval szolgálhat.
Hőmérséklet-menedzsment
A sikeres újraélesztést követő órákban gyakori a láz, amely a szakirodalom alapján egyértelműen káros a sérült agyra nézve. Logikus következtetés lehet tehát a testhőmérséklet-csökkentés kedvező hatása, amelyet baleset kapcsán kihűlt (pl. vízben elmerült), keringésmegállást elszenvedett betegek elhúzódó újraélesztése utáni jó kimeneteléről szóló esetleírások is alátámasztanak. Később állatkísérletekben ennek patofiziológiai alapjait is meghatározták: a terápiás hipotermia protektív hatása az agyi oxigénfogyasztás és metabolizmus csökkentésén, a reperfúziós károsodás, sejtmembrán- és mitochondrialis diszfunkció csökkentésén, az agyi görcsküszöb növelésén alapul. A terápiás hipotermia protektív hatását használja ki a gyermek- és felnőttkori szívsebészet olyan műtétek során, melyek egyes fázisaiban átmenetileg teljes keringésmegállításra van szükség.
A perinatalis intenzív centrumok hosszú évek óta bizonyítottan hatásos gyakorlata a perinatalis asphyxiát átélt újszülöttek terápiás hipotermiás kezelése, melynek során a lélegeztetett, szedált újszülöttet egy termosztáttal működő hűtőmatraccal 72 órán keresztül 33–34 °C-os testhőmérsékletre hűtik le. Ezzel a módszerrel az idegrendszeri károsodás bizonyítottan csökkenthető.3 A perinatalis asphyxia a keringésmegállást elszenvedő gyermekekhez képest ugyanakkor jelentősen eltérő patomechanizmusú, ráadásul jóval homogénebb betegcsoportot érint.
A gyermekkori ajánlások részben a felnőtt vizsgálatok eredményein alapulnak. Egy közelmúltban elvégzett, gyermekkori keringésmegállásokat vizsgáló, multicentrikus randomizált vizsgálat (Therapeutic Hypothermia after In-Hospital Cardiac Arrest in Children, THAPCA) kórházon kívüli alvizsgálata (THAPCA-OH, 2015) 1 évvel a keringésmegállás után nem mutatott szignifikáns különbséget túlélés vagy jó idegrendszeri kimenetel vonatkozásában a terápiás hipotermiával (32–24 C°) kezelt csoportban a terápiás normotermiás (36–37,5 C°) csoporthoz képest. Ugyanezen szerzők kórházi keringésmegállásokat követő alvizsgálatában (THAPCA-IH, 2017) szintén nem mutattak ki szignifikáns különbséget, és a vizsgálatot idő előtt leállították.4,5 Jelen adatok alapján tehát gyermekeknél mindkét megoldás egyformán jó lehet: egyes centrumok továbbra is alkalmazzák újraélesztett gyermekek esetében is a terápiás hipotermiát, mások normotermiát tartanak. További vizsgálatok várhatóak arról, hogy mely betegek profitálhatnak a terápiás hipotermia alkalmazásából.
Az aktuális európai és amerikai ajánlások alapján tehát csecsemő- és gyermekkori keringésmegállás után, amennyiben a gyermek nem tér magához, a következő javaslatok érvényesek a hőmérséklet-menedzsmentre:2,5
– Folyamatos hőmérséklet-monitorizálás
– Láz esetén agresszív lázcsillapítás
– Sikeresen újraélesztett, súlyosan hipotermiás gyermek melegítése csak 32 C°-ig
– 32 C° és 37,5 C° között szoros hőmérsékletkontroll.
Transzport
Az újraélesztett gyermekek ellátása optimálisan nagy forgalmú, multidiszciplináris gyermekintenzív centrumokban történik, a gyermekek szállítását pedig magas szintű, országszerte elérhető gyermekmentő egységek végzik. A biztonságos transzport kiemelt fontosságú mind a primer ellátás kapcsán, mind az intenzív osztályról különböző vizsgálatokra, vagy más ellátóhelyre szállítás esetében. A betegek referálása, transzportja és átadása során a manuális, szakmai tudáson túl nagyon sok múlik a nem technikai készségeken, ami többek között a betegbiztonságot garantáló, ellátók közötti kommunikáció alapja. Bármilyen betegátadáskor, beteg-előrejelzéskor vagy referáláskor jól használhatóak azok a sémák, amelyek strukturált, hatékony információátadást tesznek lehetővé, ilyen például az ISBAR séma (6. táblázat).
6. táblázat A strukturált, hatékony információátadást lehetővé tevő ISBAR séma
I Identify Bemutatkozás, betegazonosítás
S Situation Szituáció (vezető tünet/panasz)
B Background Betegségelőzmény
A Assessment Aktuális státusz
R Recommendation Kérés, javaslat
Összefoglalás
A sikeres újraélesztést követően kialakuló, keringésmegállás utáni tünetegyüttes (PCAS) korai kezelése a másodlagos agykárosodás megelőzésének, csökkentésének záloga. Egyéb kritikus állapotú betegek ellátásához hasonlóan az ABCDE séma szerint járunk el. Kiemelten fontos a normoxia, normocapnia, valamint a megfelelő perfúziós nyomás biztosítása, illetve a megfelelő görcsgátlás és vércukorkontroll. A terápiás hipotermia normotermiával szembeni előnye gyermekkori újraélesztést követően nem bizonyított, így jelenleg az ajánlások a hőmérséklet-menedzsment célértékét 32 C° és 37,5 C° közé teszik.
Irodalom:
- Van de Voorde P, et al. European Resuscitation Council Guidelines 2021: Paediatric Life Support. Resuscitation. 2021;161:327–387.
- Topjian AA, et al. Pediatric Post-Cardiac Arrest Care: A Scientific Statement From the American Heart Association. Circulation. 2019;140(6):e194–e233.
- Azzopardi D, et al. The TOBY Study. Whole body hypothermia for the treatment of perinatal asphyxial encephalopathy: a randomised controlled trial. BMC Pediatrics. 2008;8:17.
- Moler FW, et al. Therapeutic hypothermia after out-of-hospital cardiac arrest in children. The New England Journal of Medicine. 2015;372(20):1898–1908.
- Moler FW, et al. Therapeutic Hypothermia after In-Hospital Cardiac Arrest in Children. The New England Journal of Medicine. 2017;376(4):318–329.
- Nolan JP, et al. European Resuscitation Council and European Society of Intensive Care Medicine guidelines 2021: post-resuscitation care. Intensive Care Medicine. 2021;47(4):369–421.
a szerző cikkei



